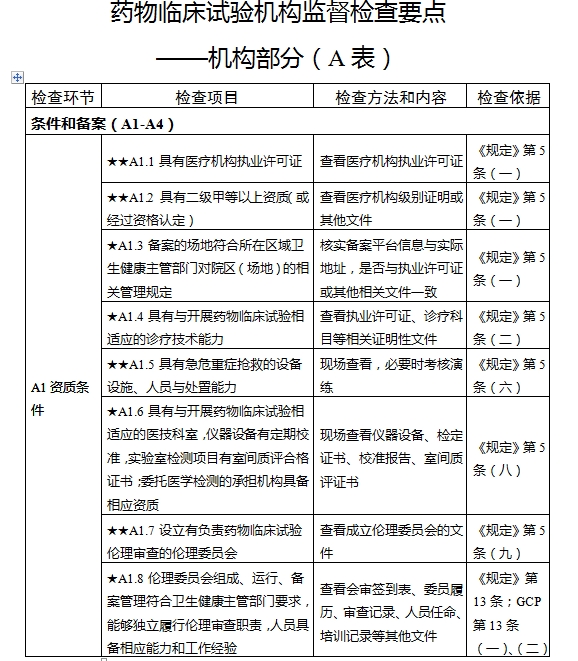
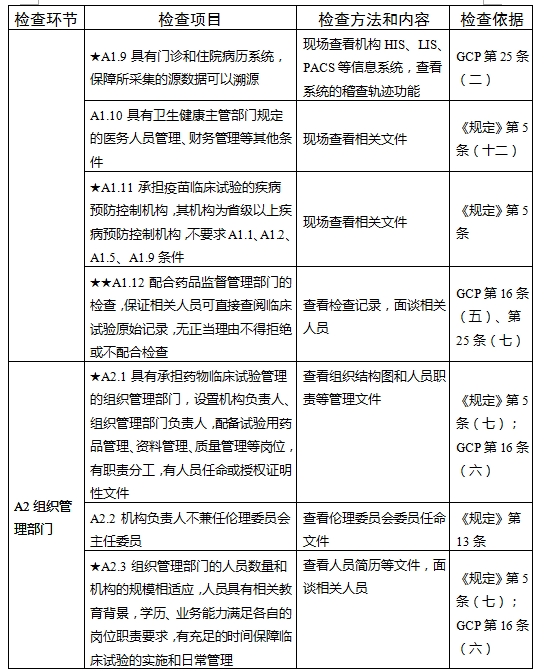
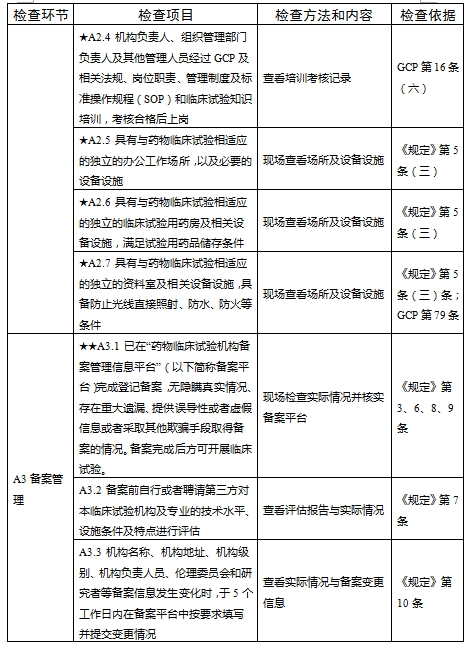
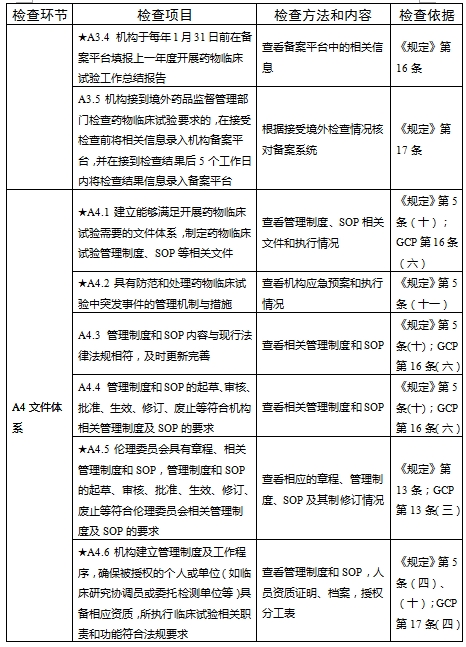
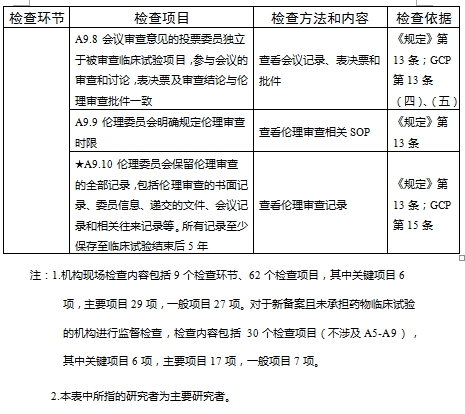
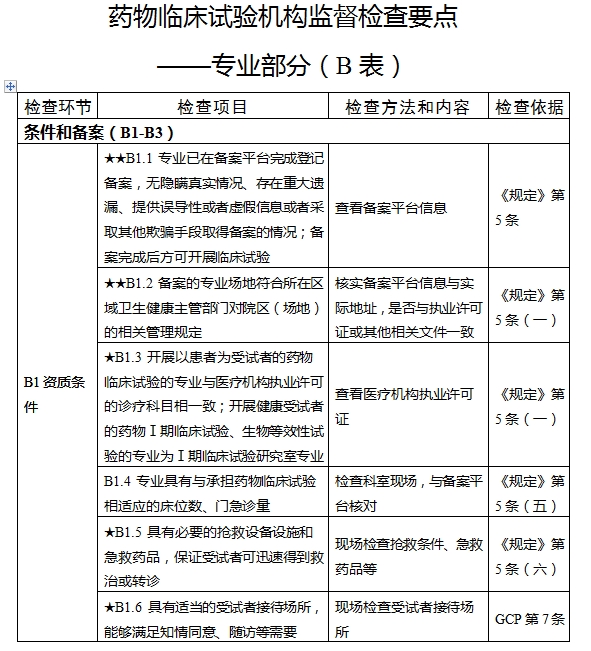
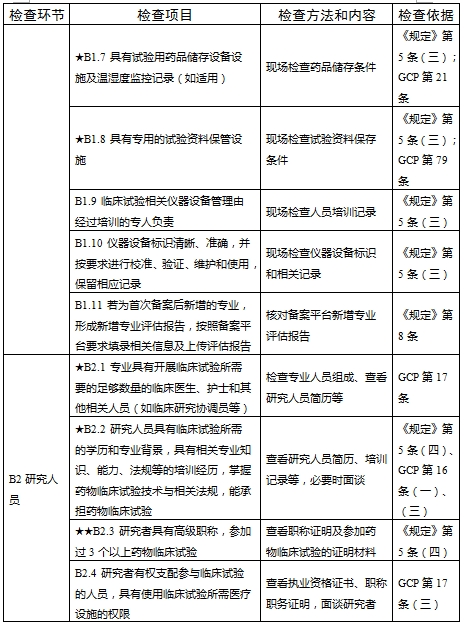
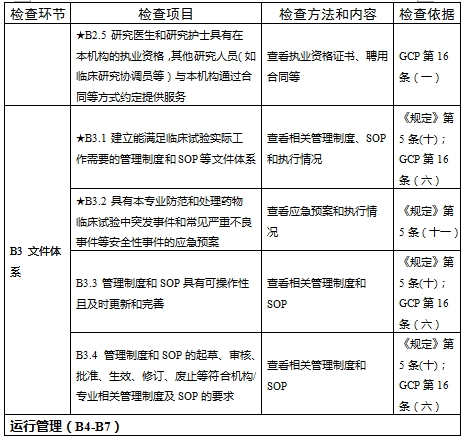
對于新備案的藥物臨床試驗機構或者增加臨床試驗專業、地址變更的,省級藥品監督管理部門、省級衛生健康主管部門依據職責對本行政區域內藥物臨床試驗機構在60個工作日內開展首次監督檢查
一、檢查內容
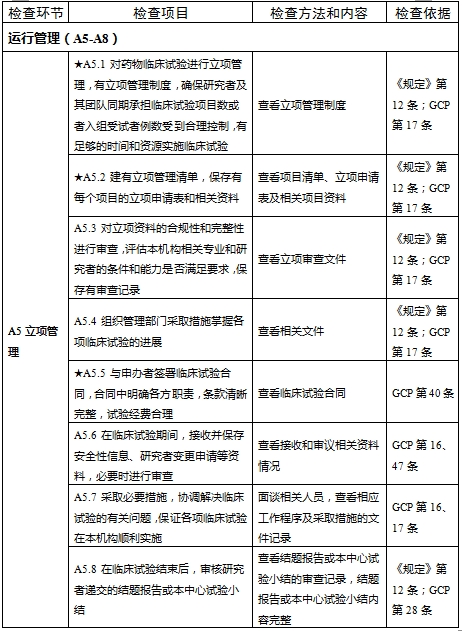
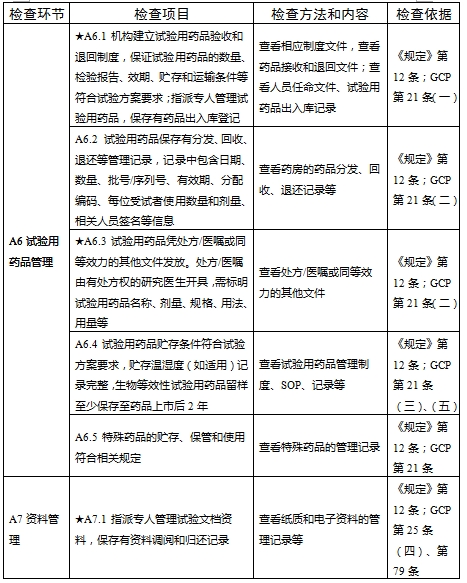
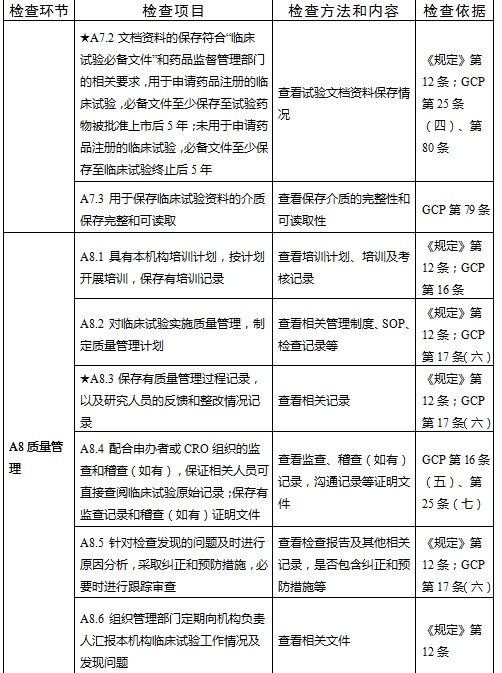
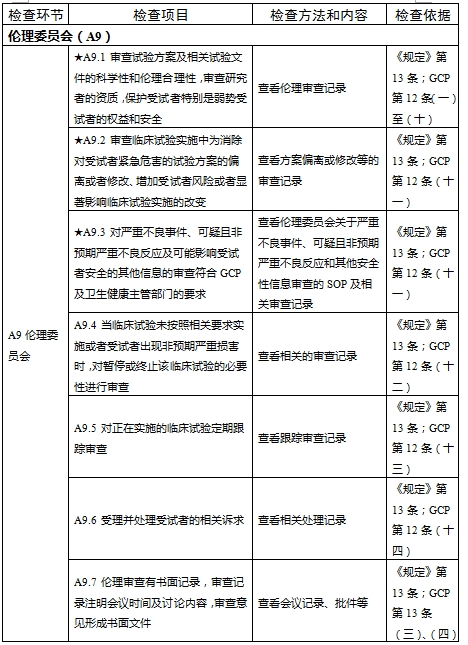
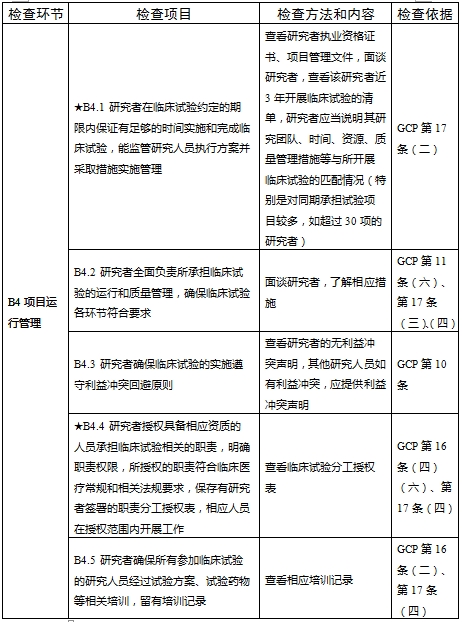
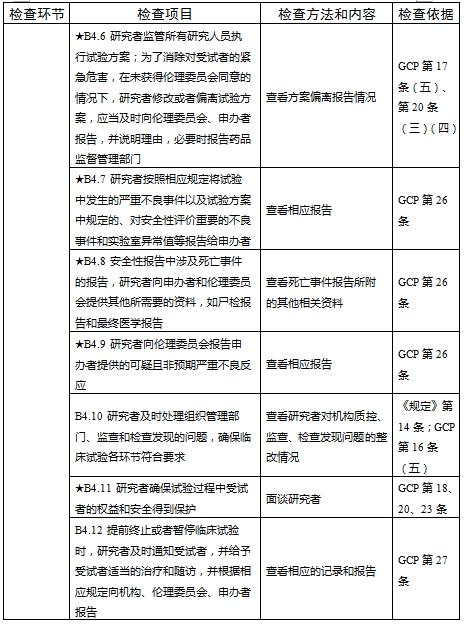
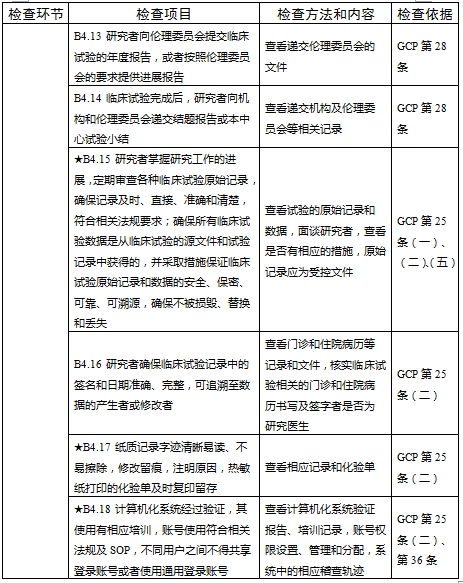
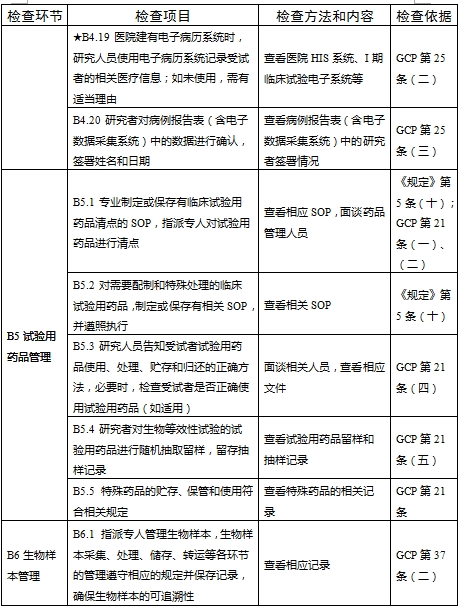
檢查要點共16個檢查環節、109個檢查項目,分為機構和臨床試驗專業(以下簡稱專業)2個部分,包含對資質條件與備案、運行管理等方面的現場檢查內容。檢查項目中關鍵項目共計9項(標示為“★★”),主要項目共計51項(標示為“★”),一般項目共計49項。
二、判定原則
檢查發現的缺陷分為嚴重缺陷、主要缺陷和一般缺陷。一般情況下,關鍵項目不符合要求判為嚴重缺陷,主要項目不符合要求判為主要缺陷,一般項目不符合要求判為一般缺陷;可以綜合相應檢查要點的重要性、偏離程度以及質量安全風險進行缺陷分級。應當對機構和專業分別作出結論。
(一)現場檢查結論的判定原則
1.未發現嚴重缺陷和主要缺陷,發現的一般缺陷少于5項,經綜合研判,所發現缺陷不影響受試者安全和/或試驗數據質量或者影響輕微,認為質量管理體系比較健全的,結論為符合要求。
2.未發現嚴重缺陷和主要缺陷,發現的一般缺陷多于或等于5項,或者未發現嚴重缺陷,存在主要缺陷,但數量少于或等于3項,經綜合研判,所發現缺陷可能影響受試者安全和/或試驗數據質量,但認為質量管理體系基本健全的,結論為待整改后評定。
3.屬于以下情形之一,經綜合研判,所發現缺陷可能嚴重影響受試者安全和/或試驗數據質量,認為質量管理體系不能有效運行或者不符合機構備案基本條件的,結論為不符合要求:
(1)嚴重缺陷1項及以上;
(2)未發現嚴重缺陷,但主要缺陷3項以上;
(3)其他不符合要求的情形。
(二)綜合評定結論的判定原則
1.發現缺陷不影響受試者安全和/或試驗數據質量或者影響輕微,認為質量管理體系比較健全的,結論為符合要求。
2.發現缺陷可能嚴重影響受試者安全和/或試驗數據質量,認為質量管理體系不能有效運行或者不符合機構備案基本條件的,結論為不符合要求。
發現缺陷可能影響受試者安全和/或試驗數據質量,現場檢查結論為“待整改后評定”,整改后仍不能達到符合要求標準的,結論為不符合要求。